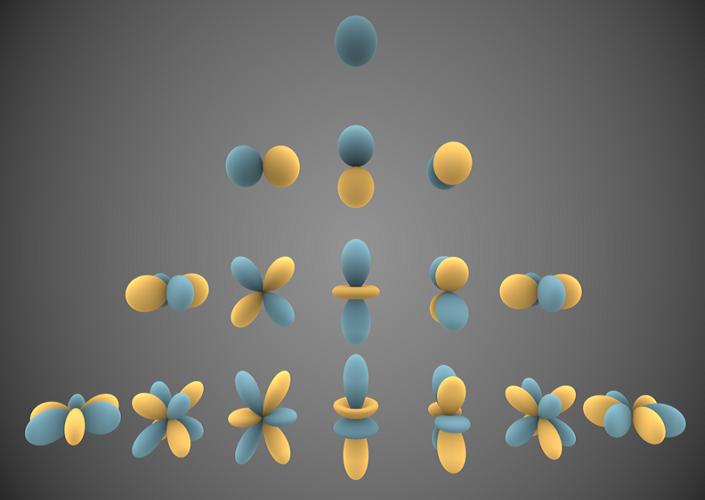Dazu gehören Energieniveaus und räumliche Aufenthaltswahrscheinlichkeiten der den Atomkern umgebenden Elektronen.
Atom-Orbitale in einer visuellen Darstellung
© Wikipedia: Inigo.quilez, 2014
|
|
| Die Atomhülle oder Elektronenhülle besteht aus den Elektronen, die von einem Atomkern gebunden sind und ihn gewöhnlich bis zu einem Abstand von der Größenordnung 10–10 m umgeben (Atomradius). Atomkern und Atomhülle zusammen bilden das Atom, wobei der Kern einen je nach chemischem Element 20.000- bis 150.000-mal kleineren Durchmesser hat als die Hülle. Die von außen zugänglichen Eigenschaften des Atoms sind daher, abgesehen von der Masse, fast ausschließlich von der Hülle bestimmt. Dazu gehören neben der Größe des Atoms seine verschiedenen möglichen Arten einer chemischen Bindung, die Möglichkeiten zur Bildung eines Moleküls oder eines kristallinen Festkörpers sowie die Emission und Absorption von elektromagnetischer Strahlung bestimmter Wellenlängen in den Bereichen Infrarot, sichtbares Licht, Ultraviolett und Röntgenstrahlen. Die Atomphysik, die sich zum großen Teil mit diesen Phänomenen beschäftigt, ist daher weitgehend eine Physik der Atomhülle. Die Anzahl der Elektronen in der Atomhülle eines neutralen Atoms ist durch die Größe der positiven elektrischen Ladung des Atomkerns gegeben. Für den Aufbau der Elektronenhülle wurden verschiedene Atommodelle entwickelt. Das erste in Teilen sehr erfolgreiche Bohrsche Atommodell (1913, Elektronen auf Kreisbahnen) wurde ab 1925 durch die wesentlich umfassenderen und genaueren quantenmechanischen Atommodelle abgelöst, die bis heute die theoretische Grundlage der Atomphysik bilden. [1] |
| Die Elektronenkonfiguration gibt im Rahmen des Schalenmodells der Atomhülle die Verteilung der einzelnen Elektronen auf verschiedene Energiezustände und damit Aufenthaltsräume (Atomorbitale) an. Der Zustand jedes Elektrons der Hülle wird nach dem Bohr-Sommerfeldschen Atommodell sowie dem Orbitalmodell durch vier Quantenzahlen bestimmt. Gemäß dem Pauli-Prinzip darf der Zustand keiner zwei Elektronen eines Atoms in allen vier Quantenzahlen übereinstimmen. Mit diesem Prinzip lässt sich zeigen, dass sich die Elektronen auf die verschiedenen erlaubten Zustände und damit auf die Schalen und Unterschalen verteilen. Die äußerste besetzte Schale (Valenzschale) bestimmt das chemische Verhalten und ist daher maßgeblich für die Einordnung ins Periodensystem der Elemente. [2] |
| Ein Atomorbital ist in den quantenmechanischen Modellen der Atome die räumliche Wellenfunktion eines einzelnen Elektrons in einem quantenmechanischen Zustand, meist in einem stationären Zustand. In den älteren Atommodellen beschreibt ein Orbital eine genaue, durch die Quantisierungsregeln ausgewählte Elektronenbahn. Diese Vorstellung wurde in der Quantenmechanik zugunsten einer diffusen Verteilung der Aufenthaltswahrscheinlichkeit des Elektrons aufgegeben. Das quantenmechanische Atomorbital erstreckt sich für gebundene Elektronen vom Atomkern im Zentrum nach außen bis ins Unendliche, wo die Aufenthaltswahrscheinlichkeit gegen Null geht. Der wahrscheinlichste Abstand vom Atomkern ist für das innerste Orbital gleich dem Radius der 1. bohrschen Kreisbahn. Anschaulich stellt man ein Orbital gewöhnlich durch die Oberfläche des kleinstmöglichen Volumens dar, in dessen Inneren sich das Elektron mit großer Wahrscheinlichkeit aufhält. Im Orbitalmodell für Atome mit mehreren Elektronen nimmt man an, dass die Elektronen sich unter Berücksichtigung des Pauli-Prinzips auf die Orbitale verteilen. Ein solcher Zustand heißt Elektronenkonfiguration und stellt oft eine brauchbare Näherung für die Struktur der Atomhülle dar, obwohl diese durch zusätzliche Elektronenkorrelationen noch komplizierter ist. Eine Vereinfachung des Orbitalmodells ist das Schalenmodell. [3] |
|
|
| Daten |
|
Erfasst werden alle bekannten Atomhüllen (bis Radium) mit ihren Elektronenschalen und als räumliche Orbitalmodelle. Anzahl: Elektronenkonfigurationen 88 Datensätze, Orbitale 44 Datensätze. |
| (1) ... |
| (2) ... |
|
|
| Quellen und Material |
| [xxx] ... |
| [xxx] ... |
|
|
| Wikipedia (de) – Listen |
| ... |
| ... |
|
|
| Wikipedia (en) – Listen |
| ... |
| ... |
|
|